7 月 25 日,国家药监局附条件批准河南真实生物科技有限公司阿兹夫定(azvudine)片增加治疗新冠病毒肺炎适应症注册申请。

国家药监局官网截图
而 2021 年 7 月 20 日,国家药监局已附条件批准阿兹夫定与其他逆转录酶抑制剂联用治疗高病毒载量的成年 HIV-1 感染患者。
此次附条件批准新增适应症后,阿兹夫定可以用于治疗普通型新冠肺炎成年患者。
国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
阿兹夫定是一种口服双靶点核苷类抗病毒药物,在体外对 HIV、HCV、EV71 和 HBV 等具有显着和广谱的抗病毒作用。
新冠病毒是一种典型的包膜单链阳性 RNA 病毒,RNA 合成需要以核苷和核苷酸为原料。核苷类抗病毒药物可以通过模仿天然核苷进入宿主细胞,再通过激酶的催化作用转化为三磷酸核苷,并在病毒 RNA 合成过程中嵌入病毒 RNA 中,导致病毒 RNA 链合成终止,以此来抑制病毒的复制。
此前,阿兹夫定在治疗 HIV 感染的 II 期临床试验展现出良好的疗效和安全性。
2020 年 7 月,阿兹夫定研发团队——河南师范大学常俊标团队——在 Advanced Science 上在线发表一篇阿兹夫定治疗轻度和普通新冠患者的随机对照临床试验。

论文截图
研究纳入 20 名轻度和普通新冠患者,并随机分为两组,一组接受阿兹夫定和对症治疗,一组接受标准抗病毒和对症治疗。
结果显示,阿兹夫定治疗组首次的平均时间为 2.6 天,短于对照组的 5.6 天;阿兹夫定治疗组没有不良事件发生,对照组有 3 起不良事件报告。
研究认为,初步结果表明,与标准抗病毒治疗相比,阿兹夫定可能会缩短轻度和普通新冠患者的核酸转阴时间。因此,有必要进行更大样本量的阿兹夫定治疗新冠的临床试验。
2021 年 12 月 6 日,常俊标团队在 Nature 子刊 Signal transduction and targeted therapy 上再次发表阿兹夫定治疗新冠的研究成果。

论文截图
在新冠感染的恒河猴中,口服阿兹夫定治疗可起到降低病毒载量、减轻炎症和器官损伤、减少胸部 X 光毛玻璃样影的作用。
同时,一项同情用药的随机单臂临床试验表明,口服阿兹夫定治愈了所有 31 名新冠患者,核酸转阴时间为 3.29 ± 2.22 天,5 名患者出现轻微和短暂的头晕、恶心。
根据 ClinicalTrials.gov,阿兹夫定用于治疗新冠肺炎的注册研究有三项,目前均无结果公布。
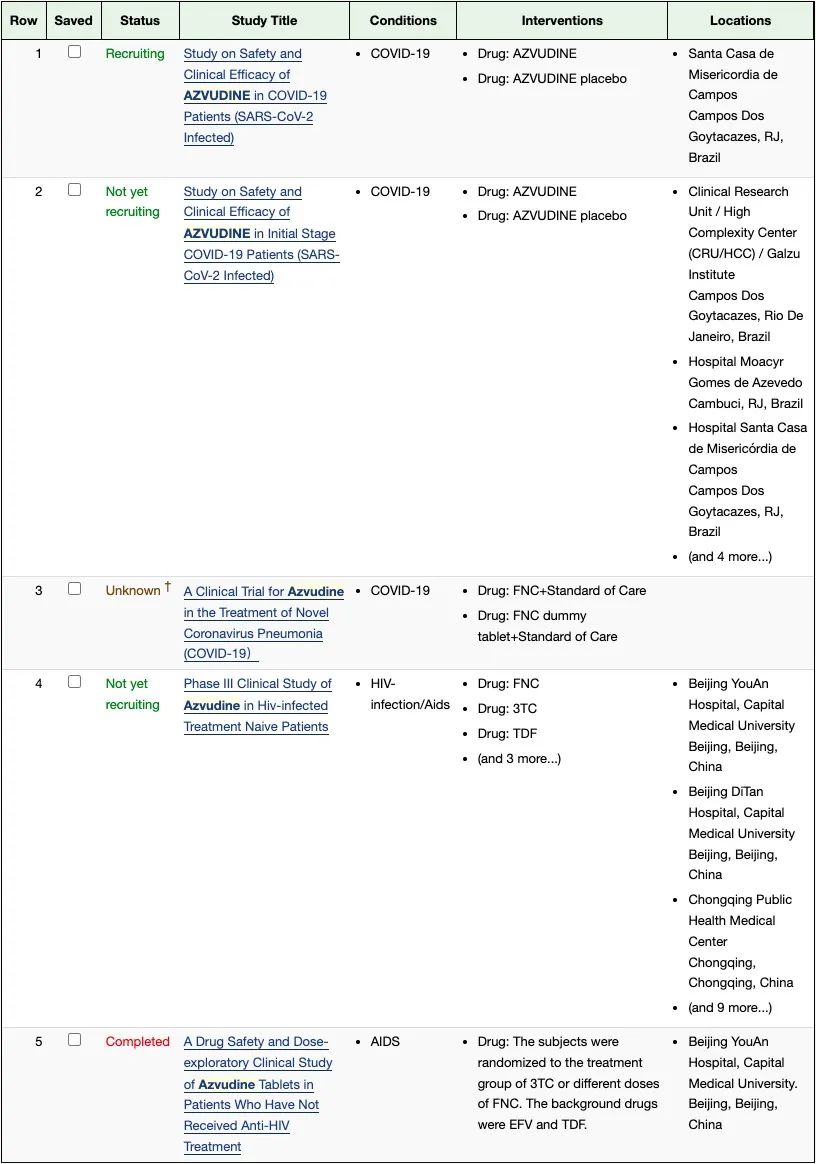
ClinicalTrials.gov 截图
2022 年 7 月 15 日,真实生物科技微信公众号发布推文,宣布阿兹夫定片治疗新型冠状病毒肺炎适应症注册 Ⅲ 期临床试验结果达到预期。

推文截图
据推文公布信息,阿兹夫定 Ⅲ 期临床试验采用多中心、随机、双盲、安慰剂对照的临床试验设计,临床试验结果显示:
1、显著改善临床症状:
阿兹夫定片可以显著缩短中度的新型冠状病毒感染肺炎患者症状改善时间,提高临床症状改善的患者比例,达到临床优效结果。首次给药后第 7 天临床症状改善的受试者比例阿兹夫定组 40.43%,安慰剂组 10.87%(P 值 <0.001),受试者临床症状改善的中位时间阿兹夫定组与安慰剂组有极显著统计学差异(P 值 <0.001)。
2、抑制新冠病毒作用:
阿兹夫定具有抑制新冠病毒的活性,病毒清除时间为 5 天左右。
3、安全性方面:
阿兹夫定片总体耐受性良好,不良事件发生率阿兹夫定组与安慰剂组无统计学差异,未增加受试者风险。
不过,目前暂未查到阿兹夫定 III 期临床试验的研究论文发表。国家药监局在通告中也表示,要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。

>> 点击查看「新型冠状病毒肺炎(儿童)」完整诊疗、用药内容
>> 点击查看「新型冠状病毒肺炎康复治疗」完整诊疗、用药内容
策划:z_popeye
监制:gyouza
题图来源:国家药监局官网截图